Etwas lustiges zum Start ins neue Jahr. Die inoffizielle Hymne des Sequenzier-Service der University of Edinburgh von der Irish-Folk-Band "Boiled in Lead".
"Dive in the Genepool down you swim"
Vergesst einfach das Video, auf den Text kommt es an, den gibt es auch nochmal zum nachlesen:
In April when your barge sailed through
I fell in love with you
Alas my paramour alack
A stranger to me 'til the test comes back
Chorus:
Oh the micro-organism
Oh the micro-organism
Dive in the gene pool down you swim
Down to where the light grows thin
Flail little fishies flail if you can
But avoid the micro-organism man
Chorus
Caffeine sugar and THC
Is all that the doctors are gonna find in me
When they do the autopsy
The micro-organism won't get me
Chorus
God is good and God is great
God's a big invertebrate
God made the river change its route
But he won't pull the micro-organism out
Chorus
The cowslips bloom and the bluebells too
Here's advice I'll give to you
Rattle your sword before you strike
And never kiss anyone you like
Chorus
Change of language, change of content
From now on this blog is about my adventures in bioinformatics and in the use of open source software:
The code is bash, perl, R -especially sweave/noweb-, LaTeX and my lovely, beastlyOS editor`s (Gnu-Emacs) elisp.
I will publish code snippets and short comments in English language. You con read about the same and my other more biology focussed interests in German on Alles was lebt.
The code is bash, perl, R -especially sweave/noweb-, LaTeX and my lovely, beastly
I will publish code snippets and short comments in English language. You con read about the same and my other more biology focussed interests in German on Alles was lebt.
Posts mit dem Label Labor werden angezeigt. Alle Posts anzeigen
Posts mit dem Label Labor werden angezeigt. Alle Posts anzeigen
Sonntag, 18. Januar 2009
Dienstag, 25. November 2008
Seeigelsex Protokoll
Als Ergaenzung zu Argent23's Post "Seeigelsex" auf Holiday Junction poste ich hier das original Protokoll der Giglio-Exkursion von 2006. Es soll ja Leute geben, die ein Mikroskop ihr eigen nennen und unter dieser einen Vorraussetzungen ist das Ganze eine wirklich spannende Urlaubsbeschaeftigung. Vielleicht stolpert ja auch der eine oder andere Kursteilnehmer bei der Vorbereitung der Versuche ueber diese Posts... Viel Spass!
Larvalentwicklung der Echinodermata
1. Einleitung
Stachelhäuter sind getrenntgeschlechtlich und pflanzen sich fort, indem sie Samenzellen und Eier direkt ins Wasser freisetzen. Das Geschlechterverhältnis ist dadurch bei vielen Arten zugunsten der Männchen auf etwa Drei zu Eins verschoben. Die meisten Arten haben pelagische Larven, die sich von Plankton ernähren. Im Gegensatz zu ihren Eltern sind die Larven bilateralsymmetrisch. Erst wenn sie sich auf dem Boden niederlassen verändert sich ihr Körper und zeigt die typische Radiärsymmetrie. In der Entwicklung der Larven wird außerdem der Urmund zum späteren After, und ein sekundärer Mund bildet sich, was die Echinodermata als Deuterostomier ausweist.
Seeigelembryonen werden daher, und weil sie leicht zugänglich und durchsichtig sind als Modellsystem für Entwicklungsvorgänge benutzt.
2.Gewinnung der Gameten
Wir benutzten für unseren Versuch den Schwarzen Seeigel, Arbacia lixula, der im Mittelmeerraum und so auch auf Giglio an allen Felsküsten häufig vorkommt.
Da die Tiere sehr empfindlich auf Kontakt mit der Luft reagieren, wurde einmal sofort am Strand versucht Eizellen und Sperma zu gewinnen, ein zweites Mal wurden andere Tiere erst im Labor der Prozedur unterzogen. Die Tiere wurden mit der Oralseite nach oben in ein Becherglas, gefüllt mit sterilfiltriertem Meerwasser, gesetzt. Zum Sterilfiltrieren hatten wir das Meerwasser mit einer Spritze und einem geeigneten Aufsatz durch einen Filter mit einer Maschenweite von 0,2μm gepresst.
Den Seeigeln wurde nun etwa 2ml Kaliumchlorid mit einer Injektionsspritze durch die Mundöffnung in die Leibeshöhle injiziert, was eine Depolarisation und ein Ausstoßen der Gameten bewirken sollte.
Dazu verwendeten wir am Strand versehentlich 30%iges (circa 5M) im Labor später 0,5 molares KCl. Trotzdem kam es bei beiden Ansätzen zu einem Ausstoßen von Gameten, wobei nicht alle Tiere wie gewünscht reagierten. Es zeigte sich dass eine schräge Injektion tief ins innere des Tieres die größte
Erfolgswahrscheinlichkeit mit sich bringt. Dies könnte daher rühren, dass so das Kaliumchlorid direkt in die Gonade seitlich unter der Apikalseite gespritzt wurde.

Folgende Tabellen zeigen die Anzahl männlicher und weiblicher Tiere, die Keimzellen ausstießen. Die Zahl in der Spalte BG gibt an wie viele Tiere weder Spermien noch Eizellen abgaben.
Strand
BG---männlich---weiblich
6------------3---------------2
Labor
BG---männlich---weiblich
4------------4---------------2
Durch die hohe Anzahl von Tieren unbestimmten Geschlechts macht eine Statistik der Geschlechterverteilung keinen Sinn. Die Gameten wurden mit einer Pipette vom Boden der Bechergläser entnommen und getrennt, gekühlt aufbewahrt.
Entwicklung der Embryonen
Wir gaben nun in zwei Petrischalen die am Strand erhaltenen Spermien zu den dort gewonnenen Eizellen und stellten eine der beiden Schalen kühl.
Ebenso verfuhren wir mit den erst im Labor erhaltenen Geschlechtszellen.
Nach der Befruchtung der bereits polar gebauten Eizelle(Polkörperchen am animalen Pol) wurde ein Eindringen weiterer Spermien durch eine Veränderung der Plasmamembran zur Befruchtungsmembran, die nun so genannte Corticalgranula als äußere Schutzschicht enthält, verhindert. Diese Befruchtungsmembran war bei allen Versuchsansätzen als dünner Kranz um die Zygote zu erkennen.

Auch die ersten beiden Furchungen, die das Ei entlang der animal-vegetativen Achse teilen konnten wir bei den bei Zimmertemperatur gelagerten Ansätzen nach ca.20 und 40 Minuten erkennen. Die im Kühlschrank gelagerten Embryonen erreichten nach etwa 20 Stunden dieses Stadium.

Nach etwa zwei Stunden hatten die Zimmertemperatur-Ansätze das 16-Zell-Stadium erreicht. Dieses entsteht nach der vierten inäqual verlaufenden Furchung und zeigt am vegetativen Pol vier kleine Mikromeren.

Nach etwa 5 Stunden befanden sich in den beiden bei Zimmertemperatur gelagerten Ansätzen bereits Blastulae. Auch die gekühlten Ansätze erreichten dieses Stadium, allerdings erst nach fünf Tagen.

Die darauf folgenden Stadien, zwischen Blastula und Larve, entwickelten sich über Nacht und konnten daher leider nicht dokumentiert werden.

Bei Beginn der Gastrulation wanderten vom vegetativen Pol etwa 40 primäre
Mesenchymzellen in das innere der Blastula. Dort stülpte sich der Darm ein, der dann mit dem Mund, der sich von der gegenüberliegenden Seite eingestülpt hatte, verschmolz.
Nach etwa 48 Stunden konnten wir im Ansatz, mit den am Strand gewonnenen
Gameten, der bei Zimmertemperatur gelagert wurde, Pluteuslarven entdecken.

Die Embryonen des im Labor gewonnenen Ansatzes waren von Pilzsporen oder
anderen Verunreinigungen zerstört. Auch die beiden im Kühlschrank gelagerten Ansätze starben nach fünf Tagen im Blastulastadium ab.
Wahrscheinlich war nur beim ersten Sterilfiltrieren des Meerwassers unser Filteraufsatz richtig dicht.
In unserem ersten Ansatz konnten wir nach drei Tagen sogar die beginnende
Metamorphose zum radiärsymmetrischen Tier beobachten. Es hatte sich am Boden der Petrischale mit einem radiärsymmetrischen Auswuchs angeheftet.

Larvalentwicklung der Echinodermata
1. Einleitung
Stachelhäuter sind getrenntgeschlechtlich und pflanzen sich fort, indem sie Samenzellen und Eier direkt ins Wasser freisetzen. Das Geschlechterverhältnis ist dadurch bei vielen Arten zugunsten der Männchen auf etwa Drei zu Eins verschoben. Die meisten Arten haben pelagische Larven, die sich von Plankton ernähren. Im Gegensatz zu ihren Eltern sind die Larven bilateralsymmetrisch. Erst wenn sie sich auf dem Boden niederlassen verändert sich ihr Körper und zeigt die typische Radiärsymmetrie. In der Entwicklung der Larven wird außerdem der Urmund zum späteren After, und ein sekundärer Mund bildet sich, was die Echinodermata als Deuterostomier ausweist.
Seeigelembryonen werden daher, und weil sie leicht zugänglich und durchsichtig sind als Modellsystem für Entwicklungsvorgänge benutzt.
2.Gewinnung der Gameten
Wir benutzten für unseren Versuch den Schwarzen Seeigel, Arbacia lixula, der im Mittelmeerraum und so auch auf Giglio an allen Felsküsten häufig vorkommt.
Da die Tiere sehr empfindlich auf Kontakt mit der Luft reagieren, wurde einmal sofort am Strand versucht Eizellen und Sperma zu gewinnen, ein zweites Mal wurden andere Tiere erst im Labor der Prozedur unterzogen. Die Tiere wurden mit der Oralseite nach oben in ein Becherglas, gefüllt mit sterilfiltriertem Meerwasser, gesetzt. Zum Sterilfiltrieren hatten wir das Meerwasser mit einer Spritze und einem geeigneten Aufsatz durch einen Filter mit einer Maschenweite von 0,2μm gepresst.
Den Seeigeln wurde nun etwa 2ml Kaliumchlorid mit einer Injektionsspritze durch die Mundöffnung in die Leibeshöhle injiziert, was eine Depolarisation und ein Ausstoßen der Gameten bewirken sollte.
Dazu verwendeten wir am Strand versehentlich 30%iges (circa 5M) im Labor später 0,5 molares KCl. Trotzdem kam es bei beiden Ansätzen zu einem Ausstoßen von Gameten, wobei nicht alle Tiere wie gewünscht reagierten. Es zeigte sich dass eine schräge Injektion tief ins innere des Tieres die größte
Erfolgswahrscheinlichkeit mit sich bringt. Dies könnte daher rühren, dass so das Kaliumchlorid direkt in die Gonade seitlich unter der Apikalseite gespritzt wurde.

Folgende Tabellen zeigen die Anzahl männlicher und weiblicher Tiere, die Keimzellen ausstießen. Die Zahl in der Spalte BG gibt an wie viele Tiere weder Spermien noch Eizellen abgaben.
Strand
BG---männlich---weiblich
6------------3---------------2
Labor
BG---männlich---weiblich
4------------4---------------2
Durch die hohe Anzahl von Tieren unbestimmten Geschlechts macht eine Statistik der Geschlechterverteilung keinen Sinn. Die Gameten wurden mit einer Pipette vom Boden der Bechergläser entnommen und getrennt, gekühlt aufbewahrt.
Entwicklung der Embryonen
Wir gaben nun in zwei Petrischalen die am Strand erhaltenen Spermien zu den dort gewonnenen Eizellen und stellten eine der beiden Schalen kühl.
Ebenso verfuhren wir mit den erst im Labor erhaltenen Geschlechtszellen.
Nach der Befruchtung der bereits polar gebauten Eizelle(Polkörperchen am animalen Pol) wurde ein Eindringen weiterer Spermien durch eine Veränderung der Plasmamembran zur Befruchtungsmembran, die nun so genannte Corticalgranula als äußere Schutzschicht enthält, verhindert. Diese Befruchtungsmembran war bei allen Versuchsansätzen als dünner Kranz um die Zygote zu erkennen.

Auch die ersten beiden Furchungen, die das Ei entlang der animal-vegetativen Achse teilen konnten wir bei den bei Zimmertemperatur gelagerten Ansätzen nach ca.20 und 40 Minuten erkennen. Die im Kühlschrank gelagerten Embryonen erreichten nach etwa 20 Stunden dieses Stadium.

Nach etwa zwei Stunden hatten die Zimmertemperatur-Ansätze das 16-Zell-Stadium erreicht. Dieses entsteht nach der vierten inäqual verlaufenden Furchung und zeigt am vegetativen Pol vier kleine Mikromeren.

Nach etwa 5 Stunden befanden sich in den beiden bei Zimmertemperatur gelagerten Ansätzen bereits Blastulae. Auch die gekühlten Ansätze erreichten dieses Stadium, allerdings erst nach fünf Tagen.

Die darauf folgenden Stadien, zwischen Blastula und Larve, entwickelten sich über Nacht und konnten daher leider nicht dokumentiert werden.

Bei Beginn der Gastrulation wanderten vom vegetativen Pol etwa 40 primäre
Mesenchymzellen in das innere der Blastula. Dort stülpte sich der Darm ein, der dann mit dem Mund, der sich von der gegenüberliegenden Seite eingestülpt hatte, verschmolz.
Nach etwa 48 Stunden konnten wir im Ansatz, mit den am Strand gewonnenen
Gameten, der bei Zimmertemperatur gelagert wurde, Pluteuslarven entdecken.

Die Embryonen des im Labor gewonnenen Ansatzes waren von Pilzsporen oder
anderen Verunreinigungen zerstört. Auch die beiden im Kühlschrank gelagerten Ansätze starben nach fünf Tagen im Blastulastadium ab.
Wahrscheinlich war nur beim ersten Sterilfiltrieren des Meerwassers unser Filteraufsatz richtig dicht.
In unserem ersten Ansatz konnten wir nach drei Tagen sogar die beginnende
Metamorphose zum radiärsymmetrischen Tier beobachten. Es hatte sich am Boden der Petrischale mit einem radiärsymmetrischen Auswuchs angeheftet.

Labels:
Deuterostomes,
Echinodermata,
German,
Labor,
Morphology,
NEUTRAL
Donnerstag, 20. November 2008
Statistik ist mehr als die drei Tests, und was ich im Moment so mache.
Der Hauptgrund warum hier nichts los ist hat nur einen Buchstaben: R.
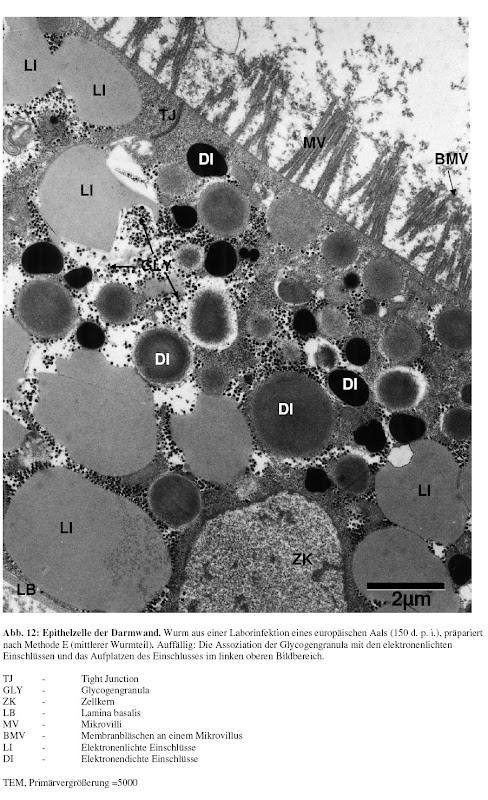
Während meiner Diplomarbeit habe ich neben meinem Interesse an Genomik auch einen Hang zu quantitativem Arbeiten entwickelt. Genauer gesagt sollte ich damals die Darmwand "meines [1]" Wurms elektronenmikroskopisch untersuchen und verschiedene Parameter dieses Epithels aus verschiedenen "experimentellen Gruppen" vergleichen(d vermessen). Ich habe mir daraufhin ein Programm beschafft mit dem ich die digitalisierten Bilder vermessen konnte und habe so eine riesigen Datensatz generiert.
Die Analyse in SPSS gestaltete sich dann folgendermaßen:
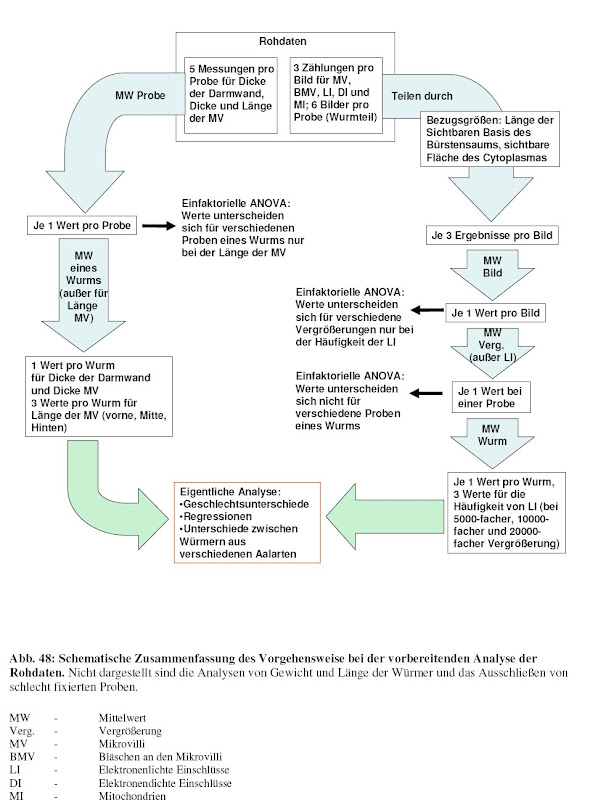
Alles was nach den erste beiden Pfeilen steht ist dabei was die Vorgehensweise bei der Datenauswertung betrifft bestenfalls nicht besonders elegant [2]. Effekte aller Variablen habe ich nacheinander in willkürlicher Weise auseinander "seziert".
Die korrekte Vorgehensweise wäre ein statistisches Modell auf die Daten anzupassen. Dabei würden dann schrittweise von einem Maximalmodell ausgehend nicht signifikante Variablen ausgeschlossen.
Einer der vielen Vorteile von R ist nun, dass es die Datenanalyse geradezu in Richtung einer solchen Modellierung lenkt.
Der Datensatz meiner Diplomarbeit ist für meine derzeitigen Fähigkeiten trotzdem noch etwas zu kompliziert. Ich beschäftige mich hauptsächlich mit Infektionsdaten, die ich Anfang des Jahres in Taiwan gesammelt habe. Es geht darum den Zusammenhang von Kapseln in der Darm- und Schwimmblasenwand mit der Infektion zu testen (die Kapseln sind tote Larven!).

Neben meiner statistischen Modellierung amplifizieren und sequenzieren wir ("mein" Diplomand Dominik) im Moment aus den Kapseln einige Gene für die wir sehr Nematoden-spezifische Primer haben.
[1] Sobald "mein" Transkriptom online ist lass ich die Anführungszeichen weg ;-)
[2] Ich wurde gerade dafür trotzdem von den Gutachtern meiner Arbeit gelobt. Das Hauptproblem an diesem Datensatz ist auch wirklich die pseudo-Replikation, darum die vielen Mittelwerte.
Während meiner Diplomarbeit habe ich neben meinem Interesse an Genomik auch einen Hang zu quantitativem Arbeiten entwickelt. Genauer gesagt sollte ich damals die Darmwand "meines [1]" Wurms elektronenmikroskopisch untersuchen und verschiedene Parameter dieses Epithels aus verschiedenen "experimentellen Gruppen" vergleichen(d vermessen). Ich habe mir daraufhin ein Programm beschafft mit dem ich die digitalisierten Bilder vermessen konnte und habe so eine riesigen Datensatz generiert.

Die Analyse in SPSS gestaltete sich dann folgendermaßen:

Alles was nach den erste beiden Pfeilen steht ist dabei was die Vorgehensweise bei der Datenauswertung betrifft bestenfalls nicht besonders elegant [2]. Effekte aller Variablen habe ich nacheinander in willkürlicher Weise auseinander "seziert".
Die korrekte Vorgehensweise wäre ein statistisches Modell auf die Daten anzupassen. Dabei würden dann schrittweise von einem Maximalmodell ausgehend nicht signifikante Variablen ausgeschlossen.
Einer der vielen Vorteile von R ist nun, dass es die Datenanalyse geradezu in Richtung einer solchen Modellierung lenkt.
Der Datensatz meiner Diplomarbeit ist für meine derzeitigen Fähigkeiten trotzdem noch etwas zu kompliziert. Ich beschäftige mich hauptsächlich mit Infektionsdaten, die ich Anfang des Jahres in Taiwan gesammelt habe. Es geht darum den Zusammenhang von Kapseln in der Darm- und Schwimmblasenwand mit der Infektion zu testen (die Kapseln sind tote Larven!).

Neben meiner statistischen Modellierung amplifizieren und sequenzieren wir ("mein" Diplomand Dominik) im Moment aus den Kapseln einige Gene für die wir sehr Nematoden-spezifische Primer haben.
[1] Sobald "mein" Transkriptom online ist lass ich die Anführungszeichen weg ;-)
[2] Ich wurde gerade dafür trotzdem von den Gutachtern meiner Arbeit gelobt. Das Hauptproblem an diesem Datensatz ist auch wirklich die pseudo-Replikation, darum die vielen Mittelwerte.
Labels:
German,
Labor,
my project,
Nematodes,
NEUTRAL
Freitag, 19. September 2008
Freitag, 25. Juli 2008
192 mal daneben
Ich hab mich wohl etwas zu sehr gefreut, dass bisher hier alles so gut lief. Fast hab ich schon daran gezweifelt, dass Molekularbiologie langwierig und schwierig ist.
Eben hatte ich auf dem Gel (nee zwei Gelen) auf die ich DNA aus 192 Kolonie-PCRs aufgetragen hab keine einzige Bande.

Von der Sorte hab ich noch eins :-(
Ich hoff das liegt an der PCR und nicht daran dass die Kolonien nix waren...
Erster Verdacht: Ich hab das Template (also die Zellen) vergessen, wär gut möglich, dass ich nur den Mastermix verteilt hab...
Das Nachzählen der kleinen Spitzen im Abfall verstärkt diesen Verdacht.
Zum Glück hab ich hier noch keine Freunde, die mich vom Arbeiten abhalten, jetzt mach ich eben nochmal acht PCRs in denen garantiert n paar E. coli schwimmen.
Ich will die verdammten Pilot-ESTs am Dienstag! Ich will!
Meine cDNA ist okay sagt diese Kollegen:


Die Kolonien sind auch schön gewachsen und waren nicht im Enferntesten blau.
Jetzt hab ich auf jeden Fall was zu tun am Wochenende...

Und meine Pipetten kann ich in den Zwischenzeiten schon der Größe nach sortieren... neee doch lieber andersherum...
Eben hatte ich auf dem Gel (nee zwei Gelen) auf die ich DNA aus 192 Kolonie-PCRs aufgetragen hab keine einzige Bande.

Von der Sorte hab ich noch eins :-(
Ich hoff das liegt an der PCR und nicht daran dass die Kolonien nix waren...
Erster Verdacht: Ich hab das Template (also die Zellen) vergessen, wär gut möglich, dass ich nur den Mastermix verteilt hab...
Das Nachzählen der kleinen Spitzen im Abfall verstärkt diesen Verdacht.
Zum Glück hab ich hier noch keine Freunde, die mich vom Arbeiten abhalten, jetzt mach ich eben nochmal acht PCRs in denen garantiert n paar E. coli schwimmen.
Ich will die verdammten Pilot-ESTs am Dienstag! Ich will!
Meine cDNA ist okay sagt diese Kollegen:


Die Kolonien sind auch schön gewachsen und waren nicht im Enferntesten blau.
Jetzt hab ich auf jeden Fall was zu tun am Wochenende...

Und meine Pipetten kann ich in den Zwischenzeiten schon der Größe nach sortieren... neee doch lieber andersherum...

Abonnieren
Posts (Atom)
